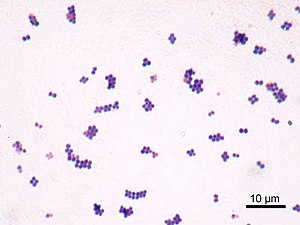

Cocos Gram positivos Cocos Gram negativos


Bacilos Gram positivos Bacilos Gram negativos
A coloração de Gram é usada para classificar bactérias com base no tamanho, morfologia celular e comportamento diante dos corantes. No laboratório de microbiologia clínica é um teste adicional rápido para o diagnóstico de agentes infecciosos, sendo também utilizado para avaliar a qualidade da amostra clínica analisada.
As interpretações dos esfregaços corados pelo Gram envolvem considerações relacionadas com as características da coloração, tamanho, forma e agrupamento das células. Estas características podem ser influenciadas por vários fatores, incluindo idade da cultura, o meio de cultivo utilizado, a atmosfera de incubação e a presença de substâncias inibidoras.
Não se pode deixar de destacar que a coloração de Gram somente será um recurso rápido e útil quando for corretamente realizada (do ponto de vista técnico) e interpretada por profissionais experientes.
Utilidade da coloração de Gram: rapidez na informação e orientação na terapia empírica, avaliação da qualidade do material colhido, sugerindo o tipo de cultura - rotina ou especial.
1 - Equipamentos e Materiais Necessários
- Lâminas de vidro limpas e desengorduradas 7,5 cm x 2,5 cm
- Tubos estéreis
- Alça bacteriológica
- Meio de cultura
- Pipeta e ponteiras estéreis
- Luvas (quando necessário)
- Cronômetro
- Salina estéril 0,85%
- Centrífuga e/ou citocentrífuga
- Lata para descartar o material contaminado
- Incinerador ou bico de Bunsen
- Óleo de imersão
- Agitador tipo Vortex
- Lâminas de bisturi
- Chapa com aquecimento brando para fixação dos esfregaços (50ºC)
- Microscópio
- Metanol ou etanol absoluto para fixação
Nota:
- Os materiais citados acima são opcionais, dependendo da amostra clínica coletada e da rotina laboratorial.
- Observar normas de biossegurança.
2 - Utilização
- Para bacterioscopia da maioria dos materiais biológicos ou culturas de microrganismos em meios sólidos ou líquidos.
- Nas amostras analisadas de culturas jovens (<< 24h) de meio de cultura sem inibidores e amostras clínicas recém-coletadas (são as que fornecem melhores resultados).
- Na verificação da morfologia bacteriana a partir de esfregaços de cultura em caldo.
3 - Esfregaços
- Os esfregaços devem ser preparados com um gradiente de espessura suficientemente denso para facilitar a visualização, mas, também, bastante esparso para revelar as características do agrupamento. Utilizar, de preferência, lâminas limpas e novas (não oxidadas). Os melhores resultados serão obtidos se as mesmas permanecerem no álcool até o momento do uso.
4 - Material Clínico
4.1. Amostra coletada com swab
- Rodar o swab suavemente pela lâmina limpa, evitando a destruição dos elementos celulares e dos grupamentos.
- Quando somente um swab for coletado, colocá-lo em um tubo estéril contendo uma pequena quantidade de salina estéril (0,4 ml) e agitar (vortex). Comprimir o swab contra as paredes do tubo e utilizá-lo para fazer o esfregaço. O restante do material pode ser inoculado nos meios de cultura.
Nota:
- Materiais clínicos coletados com swab são menos recomendados para cultura.
- Coletar, sempre que possível, dois swabs: um será utilizado para fazer o esfregaço e o outro para cultura.
4.2. Aspirados, exsudatos, etc.
- Materiais recebidos em seringas serão transferidos para um tubo estéril e agitados (vortex), quando necessário.
- Selecionar a porção mais purulenta ou mucosa com pipeta ou alça bacteriológica. Amostras muito espessas ou purulentas podem ser diluídas com uma gota de salina estéril e espalhadas sobre uma grande área da lâmina formando um esfregaço delgado.
4.3. Escarro
- Com auxílio de alça bacteriológica ou um palito de madeira, “pescar” uma porção purulenta do escarro que seja representativa. Rolar esta porção na parede do frasco para separar do material salivar. Em seguida, colocar o material na extremidade de uma lâmina limpa, confeccionando um esfregaço delgado.
- Quando a quantidade de saliva for grande e pequenas porções purulentas forem visíveis, transferir a amostra para uma placa de Petri para facilitar a retirada do material representativo.
4.4. Liquor ou outros fluidos orgânicos
- Alguns laboratórios utilizam a citocentrífuga (cytospin) para concentrar os líquidos orgânicos e fazer os esfregaços. Este método tem sido utilizado para aumentar a sensibilidade da coloração de Gram, diminuir o tempo de centrifugação e agilizar o resultado.
- Materiais aparentemente límpidos devem ser previamente centrifugados a 2.000-5.000 rpm/ 15 minutos e o esfregaço feito a partir do sedimento.
- Após a centrifugação, remover o sobrenadante com uma pipeta estéril, deixando, aproximadamente, 0,5 ml de sedimento. Colocar uma gota do sedimento numa lâmina limpa, sem espalhar. Deixar secar. Para aumentar a concentração do fluido a ser examinado, adicionar uma segunda gota na mesma área da lâmina, anteriormente utilizada.
4.5. Urina jato médio
- Homogeneizar bem o material e utilizar uma gota da amostra, sem centrifugação.
4.6. Biópsias ou fragmentos de tecido
- Colocar o material em uma placa de Petri estéril e triturar com auxílio de um bisturi.
- Preparar os esfregaços fazendo vários imprints numa lâmina limpa, de preferência, estéril.
4.7. Cultura em caldo
- Transferir uma a duas gotas para uma lâmina limpa utilizando alça bacteriológica ou pipeta.
- Espalhar suavemente o material a fim de obter um esfregaço delgado.
4.8. Colônias obtidas de meio sólido
- Utilizar uma gota de salina estéril em uma lâmina limpa.
- Transferir uma pequena porção da colônia com alça bacteriológica.
- Misturar suavemente para obter um esfregaço levemente turvo e homogêneo.
Nota:
- Para evitar a formação de aerossóis, nunca misturar o material vigorosamente.
5 - Fixação do Esfregaço
·5.1 Calor
- Todo o esfregaço, antes de ser submetido a coloração, deverá estar seco (exposto ao ar), sendo fixado com calor brando (50ºC). A fixação excessiva e o superaquecimento irão distorcer a morfologia celular e a fixação insuficiente permitirá a saída do material durante o processo de coloração. Deixar a lâmina esfriar antes de iniciar a coloração.
5.2 Metanol ou Etanol
- A fixação pelo metanol ou etanol também pode ser utilizada. Além de prevenir a lise das hemácias, evita que os esfregaços, principalmente os de urina, desprendam-se no momento da coloração.
- Deixar o esfregaço secar numa superfície plana; após, colocar uma a duas gotas de álcool (1min), drenando o excesso, sem lavar. Não aquecer a lâmina antes da coloração.
6 - Preparo do reagente para a coloração de GRAM (modificado por Hucker)
CRISTAL VOILETA - solução estoque
- Solução A - Cristal-violeta
- Álcool etílico a 95% 400 ml
- Solução B - Oxalato de amônio 16 g
- Água destilada 1600 ml
Validade das soluções A e B: 1 ano em temperatura ambiente
CRISTAL VIOLETA - solução de uso
- Solução A 40 ml
- Solução B 160 ml
LUGOL (mordente)
- Iodo metálico1 g
- Iodeto de potássio 2 g
- Água destilada 300 ml
Validade: seis meses em temperatura ambiente
Misturar o iodo e o iodeto de potássio em um graal, até que estejam bem homo-geneizados.
Acrescentar água lentamente para dissolução completa. Guardar em frasco de âmbar.
Precauções: a solução de iodo/iodeto de potássio é corrosiva. Evitar inalação, ingestão ou
contato com a pele.
DESCOLORANTES
- Álcool etílico a 95% - agente descolorante lento ou álcool etílico a 95% e acetona (v/v) - agente descolorante intermediário. Exige maior habilidade por parte do operador para que não ocorra hiperdescoloração.
Validade: um ano armazenado em frasco de âmbar a temperatura ambiente.
Precauções: etanol e acetona são inflamáveis.
CONTRACORANTE
Solução de reserva:
- safranina 5 g
- álcool etílico a 95% 500 ml
Solução de trabalho:
- solução de reserva10 ml
- água reagente 90 ml
Validade: um ano em temperatura ambiente ou fucsina básica a 0,1% ou 0,2% em água reagente.
Misturar suavemente até a dissolução.
Validade: seis meses em temperatura ambiente – frasco de âmbar.
7 - Coloração
- a) Cobrir a área com a solução de cristal-violeta por cerca de um minuto.
- b) Decantar o cristal-violeta e lavar suavemente com a própria solução de iodo ou água da torneira.
- c) Cobrir a área do esfregaço com a solução de iodo durante cerca de um minuto.
- d) Descorar a lâmina com a mistura álcool-acetona (1:1), até que o solvente escorra incolor.
Nota: Lavagem excessiva nesta etapa pode causar a retirada do cristal violeta das células Gram-positivas, assim como, a pouca descoloração pode resultar em pouca retirada do cristal violeta, ocasionando uma tonalidade azulada nas bactérias Gram-negativas.
- e) Cobrir o esfregaço com a solução de safranina (ou Fucsina básica 0.1% a 0.2%), por, cerca de 30 segundos
- f) Lavar com água corrente.
- g) Deixar secar ao ar, em temperatura branda (50ºC).
- As bactérias Gram-positivas retêm o cristal-violeta e se apresentam com coloração violeta enquanto as Gram-negativas são descoradas pelo álcool-acetona, sendo, portanto, coradas com o corante de fundo (fucsina) e se apresentam róseas.
9 - Leitura do Gram
Utilizando a objetiva de menor aumento (10X), fazer uma análise do esfregaço como um todo,
avaliando:
- a qualidade da coloração e a espessura do esfregaço;
- se o material clínico coletado é apropriado para cultura, observando a quantidade relativa de leucócitos, hemácias, células epiteliais;
- a presença de bactérias pertencentes a microbiota normal, indicando uma coleta inadequada da amostra clínica;
- localização e agrupamento bacteriano;
- filamentos, pseudo-hifas e leveduras.
Passar para a objetiva de imersão (100X) e examinar várias áreas para melhor avaliação da coloração e dos diferentes tipos de microrganismos presentes, principalmente perto de células inflamatórias.
Células e Polimorfonucleares (PMN)
Média em 10 campos (10X de aumento) Microrganismos
Média em 15 a 20 campos (100 X aumento)
Neg. + ++ +++ + ++ +++ ++++
Neg. Raras Pouca Muitas Raros Poucos Muitos Numerosos
0 1-9 10-24 >>25 <<1 1-5 6-19 >>20
10 - Causas Comuns de Erro
- Precipitação do corante: simula cocos Gram-positivos.
- Uso de lâminas que não tenham sido pré-limpas ou desengorduradas.
- Espessura do esfregaço: pode corar irregularmente.
- Superaquecimento na fixação pelo calor: destruição da morfologia.
- A descoloração insuficiente com álcool-acetona permite a retenção do cristal-violeta, o que dificulta a observação de bactérias Gram-negativas. Por outro lado, esfregaços obtidos de culturas velhas ou contendo numerosas bactérias mortas ou expostas à ação de antibióticos apresentam irregularidades na coloração. As bactérias Gram-positivas perdem a capacidade de reter o cristal-violeta, apresentando-se Gram-negativas; as Gram-negativas podem corarse mais fracamente pela safranina, podendo simular a ocorrência de infecções mistas (Grampositivas/ Gram-negativas).
- A discordância de resultado entre o esfregaço corado pelo Gram e a cultura pode estar relacionada com a coleta ou meios de transportes e conservantes inadequados.
- Um resultado positivo de Gram com cultura negativa pode sugerir contaminação do corante, presença de agentes antimicrobianos na amostra do paciente ou falha no crescimento de microrganismos devido às condições utilizadas (atmosfera, ação seletiva dos meios de cultura, etc.).
4.2.10 Controle de Qualidade
- Verificar diariamente a aparência dos reagentes. Se a solução de cristal-violeta precipitar, refiltre antes de usar. A evaporação pode afetar a eficácia dos reagentes. Recomenda-se que as soluções de trabalho sejam trocadas regularmente, dependen-do da demanda.
- Diariamente e quando novos reagentes forem preparados, corar, juntamente com os esfregaços da rotina, lâminas controles. Esfregaços de Escherichia coli (ATCC 25922) e Staphylococcus epidermidis (ATCC 12228) ou Staphylococcus aureus (ATCC 25922) são preparados e fixados. Resultados esperados:
- a) bacilos Gram-negativos, coloração rósea.
- b) cocos Gram-positivos, coloração violeta.
- Sistema de revisão dos resultados do Gram:
- c) a revisão diária de lâminas de Gram, selecionadas pelo supervisor, pode ajudar a determinar a necessidade de treinamento e adicionar informações de relevância clínica.
- d) comparar resultados da cultura com a leitura do Gram.
- Fazer manutenção preventiva e limpeza dos microscópios.